【產品名稱】
通用名稱:地舒單抗抗體定性檢測試劑盒(酶聯免疫法)
英文名稱:Denosumab ELISA
【包裝規格】
96人份/盒
【預期用途】
本試劑盒用于定性分析人血清或血漿樣本中的地舒單抗抗體。僅供科研使用。
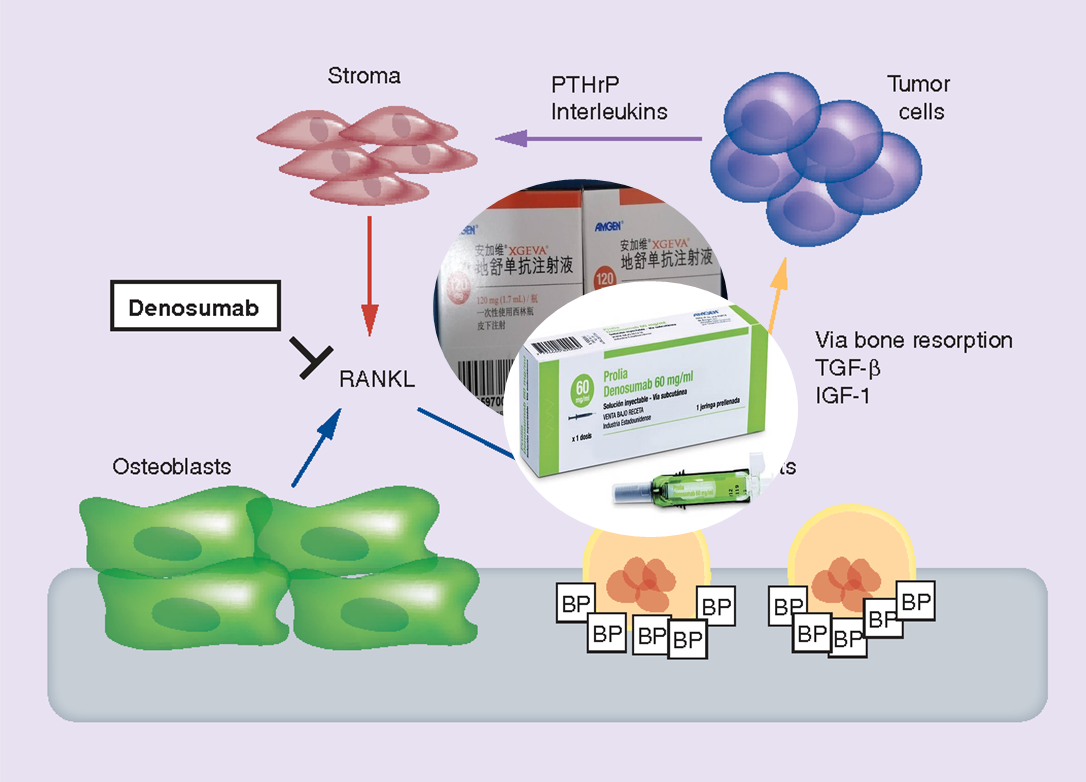
【背景知識】
地舒單抗是一種新型全人源IgG2單克隆抗體,特異于核因子Kappa-B受體活化因子配體(RANKL),可抑制多種轉移性腫瘤患者的骨吸收標志物,目前正在多項臨床試驗中進行研究,以預防和治療骨轉移。化學上,它由2條重鏈和2條輕鏈組成。每條輕鏈由215個氨基酸組成。每條重鏈由448個氨基酸和4分子內二硫化物組成。
地舒單抗旨在靶向RANKL(RANK配體),這是一種作為主要信號促進骨移除或再吸收的蛋白質。在許多骨質流失中,RANKL壓制了人體對骨質破壞的天然防御。地舒單抗阻止RANKL激活破骨細胞及其前體表面的受體RANK。防止 RANKL/RANK相互作用會抑制破骨細胞的形成、功能和存活,從而減少骨吸收,增加皮質骨和松質骨的骨量和強度。
治療藥物監測(TDM)是在指定的時間間隔測量特定藥物的臨床實踐,以保持患者血液中的恒定濃度,從而優化個體給藥方案。藥物監測的適應癥包括療效、依從性、藥物-藥物相互作用、毒性避免和治療停止監測。此外,TDM有助于發現不依從患者的用藥依從性問題。
21世紀,生物醫藥產品(生物制劑)改變了世界范圍內血液或實體惡性腫瘤患者的治療格局。如今,隨著第一波生物制劑的專利獨占期即將到期或已經到期,一些生物仿制藥產品(即被認為在質量、安全性和有效性方面與批準的“仿制”生物制劑類似的生物制劑)正在開發或已被批準供人類使用。
與所有生物制劑一樣,生物仿制藥是一種結構復雜的蛋白質,通常使用轉基因動物、細菌或植物細胞培養系統制造。由于這種分子復雜性和制造過程的獨有性質,不可避免地會導致使用不同的宿主細胞系和表達系統以及制造條件的相關差異,因此不可能制造出與“仿制”生物制劑一樣的精確制劑。
當給患者服用時,所有治療性蛋白質都有可能誘發不必要的免疫反應(即刺激抗藥物抗體[ADAs]的形成)。免疫反應的影響范圍從無明顯影響到藥代動力學變化、療效喪失和嚴重不良事件。此外,生物制劑的免疫原性特征可能會因其生產過程中的微小差異而顯著改變,這些差異伴隨著產品屬性的變化,以及給藥計劃、給藥途徑或患者群體的差異。
【主要組成成分】
1. 包被抗體的微孔板: 12×8孔條。孔內預包反應物,包裝于帶干燥劑的鋁箔袋中。
2. 質控品:1ml×2瓶。陰性質控品和陽性質控品。
3. 樣本緩沖液:50ml×1瓶。
4. 酶結合物:12ml×1瓶。
5. TMB底物:12ml×1瓶。
6. 終止液:12ml×1瓶。
7. 20×濃縮洗液:50ml×1瓶。
8. 封板膜:2片
9. 說明書:1份
10. 質控報告單:1份
注:同一次實驗請勿混用不同批次或不同試劑盒的試劑組分。
【儲存條件及有效期】
試劑盒應在2-8°C下儲存。應遠離熱源或避免陽光直射。已開封的微孔板條,在2-8°C下保存在密封袋中,可穩定至試劑盒標示的有效期。
工作洗液配制后須儲存于密封容器中,在2-8℃下可保存2周。
生產日期及失效日期見試劑盒標簽。
【適用儀器】
適用于具有450nm波長和650nm波長的酶標儀。
【樣本要求】
血清、血漿(EDTA、肝素)應遵守靜脈穿刺的常規預防措施。請勿使用溶血、黃疸或血脂樣本。實驗前,應先對混濁的樣本進行離心,以去除任何顆粒物質。應避免血清或血漿樣本反復凍融。
實驗前,應按照【試劑準備】中給出的稀釋比例對樣本進行稀釋。
藥物輸注可能會偽裝或掩蓋血清或血漿樣本中藥物抗體的存在。因此,采血時間對于抗體檢測至關重要。建議在預定劑量(峰谷樣本)之前采集血樣。
血清或血漿樣本在2-8℃可保存2天,在-20℃下可保存6個月。
【參考文獻】
1.Amgen Prolia (denosumab) product insert.
2.Malan J, Ettinger K, Naumann E, Beirne OR. The
relationship of denosumab pharmacology and
osteonecrosis of the jaws. Oral Surg Oral Med Oral Pathol Oral Radiol 2012 Dec;114(6):671-6.

